กำเนิดตารางธาตุ...เคยสงสัยไหมว่าธาตุตัวสุดท้ายในตารางธาตุคือธาตุอะไร?
ตั้งแต่เริ่มเรียนเคมีหรืออาจจะเริ่มเรียนวิทยาศาสตร์ ม.ต้น
ผู้อ่านคงคุ้นเคยกับการให้ท่องตารางธาตุ มากบ้าง น้อยบ้าง แตกต่างกันไป
ผู้อ่านเคยทราบไหมคะ ว่าการจัดเรียงธาตุเป็นกลุ่มๆ แบบนี้มีที่มาอย่างไร
และจริงๆ แล้วเราอาจไม่เคยรู้เลยว่าธาตุในโลกนี้มีอยู่กี่ตัว
เพราะมีการค้นพบกันอยู่เรื่อยๆ ตามทันบ้าง ไม่ทันบ้าง
ผู้อ่านทราบไหมคะว่า "ปัจจุบันตารางธาตุถูกเติมเต็มถึงธาตุตัวที่เท่าไรแล้ว และจะสิ้นสุดเมื่อไร?"
ในศตวรรษที่ 18 ธาตุถูกค้นพบเพียงไม่กี่ธาตุ นักวิทยาศาสตร์คนแรก
คือ โยฮันน์ โวลฟ์กัง เดอเบอไรเนอร์ ได้เสนอการจัดแบ่งธาตุออกเป็นกลุ่มๆ กลุ่มละ 3 ธาตุ
ที่มีคุณสมบัติเหมือนๆ กัน โดยเรียกการจัดแบบนี้ว่าไตรแอดส์ (ชุดสาม)
โดยพบว่าธาตุตรงกลางจะมีมวลอะตอมเป็นค่าเฉลี่ยของมวลอะตอมอีกสองธาตุที่เหลือ
เช่น กลุ่มที่ 1 ได้แก่ธาตุลิเทียม (Li) โซเดียม (Na) โพแทสเซียม (K)
ตามหลักการนี้ธาตุโซเดียมซึ่งเป็นธาตุตรงกลางระหว่างธาตุลิเทียมและโพแทสเซียมจะมีมวลอะตอมเป็น 23
ซึ่งเป็นค่าเฉลี่ยของมวลอะตอมของลิเทียมคือ 7 และ โพแทสเซียมคือ 39
แต่ในเวลาต่อมาเมื่อนำหลักการดังกล่าวไปใช้กับธาตุกลุ่มอื่นที่มีสมบัติคล้ายกัน
มวลอะตอมของธาตุตรงกลางกลับไม่ได้ตรงกับมวลอะตอมเฉลี่ยของธาตุทั้งสองที่เหลือ
หลักการจัดตารางธาตุแบบไตรแอดส์ของเดอเบอไรเนอร์จึงไม่เป็นที่ยอมรับอีกต่อไป

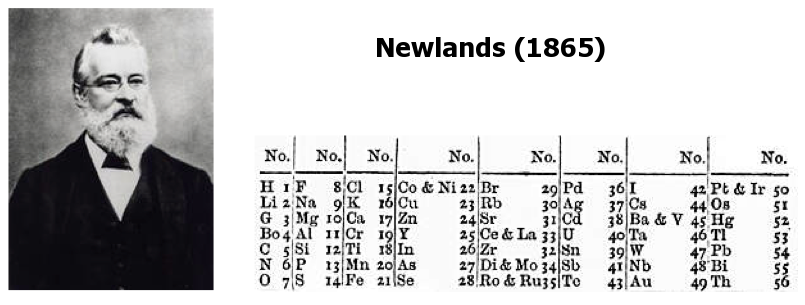
ต่อมาในปี ค.ศ. 1865 จอห์น นิวแลนด์ นักวิทยาศาสตร์ชาวอังกฤษ
ได้เสนอการจัดเรียงธาตุเป็นหมวดหมู่ขึ้นใหม่ โดยเรียงตามลำดับมวลอะตอม
นิวแลนด์กล่าวว่าถ้านำธาตุมาเรียงตามลำดับมวลอะตอมแล้ว
พบว่า "ธาตุที่ 8 จะมีสมบัติคล้ายคลึงกับธาตุตัวที่ 1 โดยยกเว้นธาตุไฮโดรเจนและแก๊สเฉื่อย"
กฎของนิวแลนด์นี้เรียกว่า “Law of octaves”
ตัวอย่างเช่น ถ้าเริ่มต้นจากลิเทียม (มวลอะตอม = 7) เป็นธาตุตัวที่ 1
ธาตุโซเดียม (น้ำหนักอะตอม = 23) จะเป็นธาตุตัวที่ 8
โดยธาตุทั้งสองมีสมบัติทางเคมีและทางฟิสิกส์คล้ายคลึงกัน
อย่างไรก็ตามการจัดตารางธาตุแบบนิวแลนด์ยังมีข้อจำกัด
คือสามารถใช้ได้เพียงแค่น้ำหนักอะตอมไม่เกินธาตุแคลเซียม (Ca)
ต่อมาเมื่อมีการค้นพบแก๊สเฉื่อยก็ไม่สามารถจัดตามตารางธาตุของนิวแลนด์ได้
และไม่สามารถอธิบายได้ว่าเพราะเหตุใดมวลอะตอม
จึงมีความสัมพันธ์กับความคล้ายคลึงกันของสมบัติของธาตุ ตามหลักการดังกล่าว
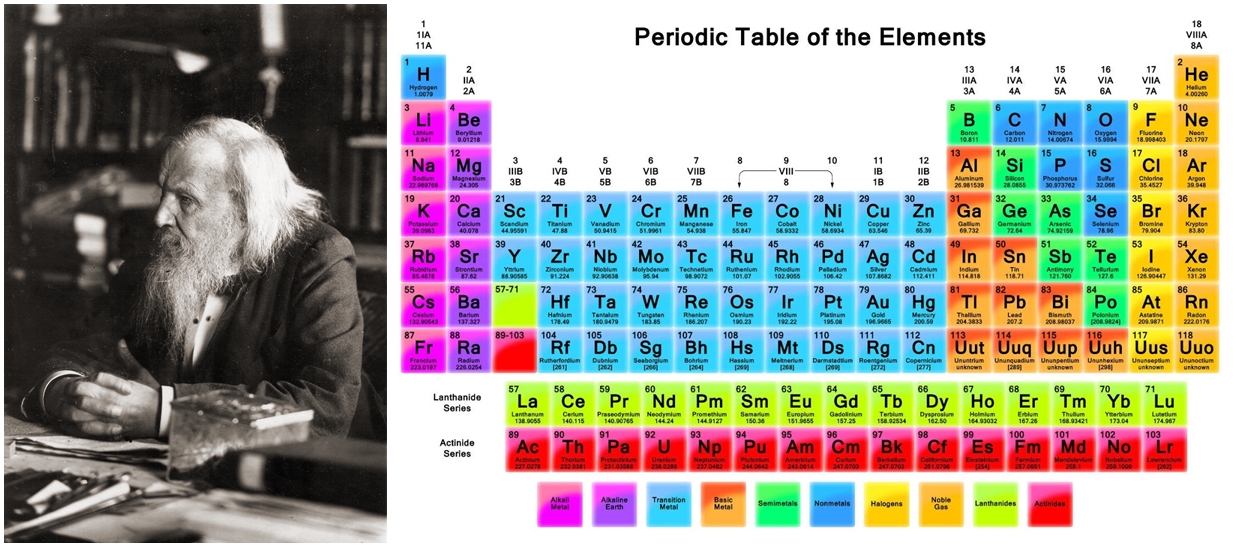
ต่อมายูลิอุสโลทาร์ ไมเออร์ นักวิทยาศาสตร์ชาวเยอรมัน
และดิมิทรี อิวาโนวิช เมนเดเลเอฟ นักวิทยาศาสตร์ชาวรัสเซีย
ได้ศึกษารายละเอียดของธาตุต่าง ๆ มากขึ้นและมีข้อสังเกตเป็นอย่างเดียวกันในเวลาใกล้เคียงกัน
ว่าถ้าจัดเรียงธาตุตามมวลอะตอมจากน้อยไปหามาก
ธาตุจะมีสมบัติคล้ายกันเป็นช่วงๆ ซึ่งเมนเดเลเอฟตั้งเป็นกฎเรียกว่า "กฎพิริออดิก"
และได้เสนอความคิดนี้ในปี 1869 ก่อนที่ไมเออร์จะนำผลงานของเขาออกเผยแพร่ในปีต่อมา
และเพื่อเป็นการให้เกียรติแก่เมนเดเลเอฟ
จึงใช้ชื่อว่า ตารางพิริออดิกของเมนเดเลเอฟ
โดยในตอนนั้นเมนเดเลเอฟได้จัดธาตุที่มีสมบัติคล้ายคลึงกันที่ปรากฏซ้ำกันเป็นช่วง ๆ
ให้อยู่ในแนวตั้งหรือหมู่เดียวกันและพยายามเรียงลำดับมวลอะตอมของธาตุจากน้อยไปหามาก
ถ้าเรียงตามมวลอะตอมแล้วมีสมบัติไม่สอดคล้องกัน
ก็พยายามจัดให้เข้าหมู่โดยเว้นช่องว่างไว้ในตำแหน่งที่คิดว่าน่าจะเป็นธาตุที่ยังไม่มีการค้นพบ
และยังได้ใช้สมบัติของธาตุและสารประกอบอื่นๆ
นอกเหนือจากคลอไรด์และออกไซด์มาประกอบการพิจารณาด้วย
โดยตำแหน่งของธาตุในตารางจะมีความสัมพันธ์กับสมบัติของธาตุ
ซึ่งช่วยให้เมนเดเลเอฟสามารถทำนายสมบัติของธาตุในช่องว่างที่ยังไม่มีการค้นพบได้อย่างใกล้เคียง
จริงๆ แล้วธาตุยูเรเนียม (เลขอะตอม =92) เป็นธาตุที่หนักที่สุดที่พบได้ในธรรมชาติ
แต่นักวิทยาศาสตร์ก็พยายามสังเคราะห์ธาตุที่หนักมากกว่า
โดยการให้โปรตอนเพิ่มเข้าไปในนิวเคลียสของธาตุใดๆ
ผ่านปฏิกิริยาฟิวชั่น ในช่วงหลายปีที่ผ่านมา
นักวิทยาศาสตร์สามารถสร้างธาตุที่หนักมากกว่ายูเรเนียมและหนักมากขึ้นไปเรื่อยๆ
ได้สำเร็จหลายธาตุ ซึ่งนักวิทยาศาสตร์เหล่านั้นต่างอยากทราบว่าอะตอมที่ใหญ่ที่สุด
จะใหญ่ได้สักเท่าไร มีโปรตอนสูงสุดเท่าไร และตารางธาตุที่เราใช้กันอยู่จะสิ้นสุดที่ธาตุใด
แต่เดิมนักวิทยาศาสตร์คาดว่าธาตุโลหะซุปเปอร์เฮฟวี่ (Super-heavy Metal คือธาตุที่มีจำนวนโปรตอน 104 ขึ้นไป) นั้น
น่าจะมีค่าครึ่งชีวิตที่ยาวนาน จึงเป็นที่น่าสนใจและพยายามค้นหาธาตุเหล่านั้น
แต่ปรากฏว่ายิ่งมีการเพิ่มนิวตรอนและโปรตอนลงไปในนิวเคลียสลงไปมากเท่าใด
อะตอมก็ยิ่งมีความเสถียรน้อยลง ธาตุโลหะซุปเปอร์เฮฟวี่ส่วนใหญ่จึงอยู่ได้เพียงแค่เพียงไมโครหรือนาโนวินาทีเท่านั้น
อย่างไรก็ตามหลังจากมีการสร้างธาตุโลหะซุปเปอร์เฮฟวี่ได้มากขึ้นก็มีข้อสังเกต
จนกระทั่งตั้งเป็นทฤษฎีที่เกี่ยวกับความเสถียรของธาตุซุปเปอร์เฮฟวี่เหล่านี้ว่า
ถ้าเพิ่มจำนวนเลขอะตอมไปถึงค่าๆ หนึ่ง ธาตุซุปเปอร์เฮฟวี่ที่ได้
จะมีเสถียรภาพมากและอยู่ได้นานขึ้น เรียกทฤษฎีนี้ว่า Island of stability
โดยคาดการณ์กันว่าธาตุตัวที่จะมีเสถียรภาพมากพอที่จะตรวจสอบได้คือธาตุที่ 120
เพราะจะมีสมบัติแบบธาตุหมู่ 2 (แอลคาไลน์ เอิร์ท)
ซึ่งปัจจุบัน นักวิทยาศาสตร์ก็ยังคงรอคอยการพิสูจน์ทฤษฎีนี้อย่างใจจดใจจ่อกันเลยทีเดียว

ในปี 2010 นักวิทยาศาสตร์ชาวรัสเซียและอเมริกาได้ร่วมมือกันนำเสนอ
การสังเคราะห์และตรวจสอบถึงการมีอยู่ของธาตุชนิดใหม่ที่มีเลขอะตอม 117
และมีชื่อชั่วคราวว่า อุนอุนเซพเทียม
http://www.vcharkarn.com/vnews/448724
ต่อมาเมื่อต้นปี 2014 นักวิทยาศาสตร์ชาวเยอรมันสามารถสังเคราะห์ธาตุชนิดใหม่นี้ได้อีกครั้ง
รวมทั้งตรวจสอบสมบัติของธาตุชนิดนี้ด้วย ธาตุนี้หนักเป็นอันดับสอง รองจากอุนอุนออกเทียม
ที่มีเลขอะตอมเท่ากับ 118 และเพิ่งค้นพบก่อนหน้าไม่นาน
โดยธาตุอุนอุนเซพเทียมได้สังเคราะห์ขึ้นจากแคลเซีม (เลขอะตอม 20)
และเบอร์เคลเลียม (เลขอะตอม 97) ขณะนี้อยู่ระหว่างการตั้งชื่ออย่างเป็นทางการ
จาก International Union of Pure and Applied Chemistry (IUPAC)
อย่างไรก็ตามการค้นพบธาตุตัวที่ 117 ซึ่งเป็นธาตุตัวใหม่ล่าสุด
ก็ทำให้ตารางธาตุถูกเติมเต็มในแถวที่ 7 โดยครบสมบูรณ์
และช่วยสนับสนุนแนวความคิด Island of stability ด้วย
จากนั้นเราก็ต้องมารอธาตุตัวต่อไปที่จะถูกค้นพบ
และมาเริ่มต้นแถวที่ 8 รวมทั้งการพิสูจน์แนวความคิด Island of stability ว่าถูกต้อง เป็นจริงหรือไม่
และต้องรอติดตามกันต่อไปว่าธาตุในตารางธาตุจะถูกค้นพบไปเรื่อยๆ หรือจะหยุดเพียงแค่ธาตุตัวใดตัวหนึ่ง
ป.ล. เป็นบทความดีดีที่เขือไปเจอมา หวังว่าจะเป็นประโยชน์ต่อใครหลายๆ คน
แวะเข้าไปดูกันได้ที่
http://www.vcharkarn.com/varticle/500208
[Spoil] คลิกเพื่อดูข้อความที่ซ่อนไว้
บทความนี้เขียนโดย : อันดา
ผู้ช่วยวิจัย/นิสิตปริญญาเอก
สาขา Polymer Science
The Petroleum and Petrochemical College
จุฬาลงกรณ์มหาวิทยาลัย

ตารางธาตุ...เคยสงสัยไหมว่าธาตุตัวสุดท้ายในตารางธาตุคือธาตุอะไร?
ตั้งแต่เริ่มเรียนเคมีหรืออาจจะเริ่มเรียนวิทยาศาสตร์ ม.ต้น
ผู้อ่านคงคุ้นเคยกับการให้ท่องตารางธาตุ มากบ้าง น้อยบ้าง แตกต่างกันไป
ผู้อ่านเคยทราบไหมคะ ว่าการจัดเรียงธาตุเป็นกลุ่มๆ แบบนี้มีที่มาอย่างไร
และจริงๆ แล้วเราอาจไม่เคยรู้เลยว่าธาตุในโลกนี้มีอยู่กี่ตัว
เพราะมีการค้นพบกันอยู่เรื่อยๆ ตามทันบ้าง ไม่ทันบ้าง
ผู้อ่านทราบไหมคะว่า "ปัจจุบันตารางธาตุถูกเติมเต็มถึงธาตุตัวที่เท่าไรแล้ว และจะสิ้นสุดเมื่อไร?"
ในศตวรรษที่ 18 ธาตุถูกค้นพบเพียงไม่กี่ธาตุ นักวิทยาศาสตร์คนแรก
คือ โยฮันน์ โวลฟ์กัง เดอเบอไรเนอร์ ได้เสนอการจัดแบ่งธาตุออกเป็นกลุ่มๆ กลุ่มละ 3 ธาตุ
ที่มีคุณสมบัติเหมือนๆ กัน โดยเรียกการจัดแบบนี้ว่าไตรแอดส์ (ชุดสาม)
โดยพบว่าธาตุตรงกลางจะมีมวลอะตอมเป็นค่าเฉลี่ยของมวลอะตอมอีกสองธาตุที่เหลือ
เช่น กลุ่มที่ 1 ได้แก่ธาตุลิเทียม (Li) โซเดียม (Na) โพแทสเซียม (K)
ตามหลักการนี้ธาตุโซเดียมซึ่งเป็นธาตุตรงกลางระหว่างธาตุลิเทียมและโพแทสเซียมจะมีมวลอะตอมเป็น 23
ซึ่งเป็นค่าเฉลี่ยของมวลอะตอมของลิเทียมคือ 7 และ โพแทสเซียมคือ 39
แต่ในเวลาต่อมาเมื่อนำหลักการดังกล่าวไปใช้กับธาตุกลุ่มอื่นที่มีสมบัติคล้ายกัน
มวลอะตอมของธาตุตรงกลางกลับไม่ได้ตรงกับมวลอะตอมเฉลี่ยของธาตุทั้งสองที่เหลือ
หลักการจัดตารางธาตุแบบไตรแอดส์ของเดอเบอไรเนอร์จึงไม่เป็นที่ยอมรับอีกต่อไป
ต่อมาในปี ค.ศ. 1865 จอห์น นิวแลนด์ นักวิทยาศาสตร์ชาวอังกฤษ
ได้เสนอการจัดเรียงธาตุเป็นหมวดหมู่ขึ้นใหม่ โดยเรียงตามลำดับมวลอะตอม
นิวแลนด์กล่าวว่าถ้านำธาตุมาเรียงตามลำดับมวลอะตอมแล้ว
พบว่า "ธาตุที่ 8 จะมีสมบัติคล้ายคลึงกับธาตุตัวที่ 1 โดยยกเว้นธาตุไฮโดรเจนและแก๊สเฉื่อย"
กฎของนิวแลนด์นี้เรียกว่า “Law of octaves”
ตัวอย่างเช่น ถ้าเริ่มต้นจากลิเทียม (มวลอะตอม = 7) เป็นธาตุตัวที่ 1
ธาตุโซเดียม (น้ำหนักอะตอม = 23) จะเป็นธาตุตัวที่ 8
โดยธาตุทั้งสองมีสมบัติทางเคมีและทางฟิสิกส์คล้ายคลึงกัน
อย่างไรก็ตามการจัดตารางธาตุแบบนิวแลนด์ยังมีข้อจำกัด
คือสามารถใช้ได้เพียงแค่น้ำหนักอะตอมไม่เกินธาตุแคลเซียม (Ca)
ต่อมาเมื่อมีการค้นพบแก๊สเฉื่อยก็ไม่สามารถจัดตามตารางธาตุของนิวแลนด์ได้
และไม่สามารถอธิบายได้ว่าเพราะเหตุใดมวลอะตอม
จึงมีความสัมพันธ์กับความคล้ายคลึงกันของสมบัติของธาตุ ตามหลักการดังกล่าว
ต่อมายูลิอุสโลทาร์ ไมเออร์ นักวิทยาศาสตร์ชาวเยอรมัน
และดิมิทรี อิวาโนวิช เมนเดเลเอฟ นักวิทยาศาสตร์ชาวรัสเซีย
ได้ศึกษารายละเอียดของธาตุต่าง ๆ มากขึ้นและมีข้อสังเกตเป็นอย่างเดียวกันในเวลาใกล้เคียงกัน
ว่าถ้าจัดเรียงธาตุตามมวลอะตอมจากน้อยไปหามาก
ธาตุจะมีสมบัติคล้ายกันเป็นช่วงๆ ซึ่งเมนเดเลเอฟตั้งเป็นกฎเรียกว่า "กฎพิริออดิก"
และได้เสนอความคิดนี้ในปี 1869 ก่อนที่ไมเออร์จะนำผลงานของเขาออกเผยแพร่ในปีต่อมา
และเพื่อเป็นการให้เกียรติแก่เมนเดเลเอฟ
จึงใช้ชื่อว่า ตารางพิริออดิกของเมนเดเลเอฟ
โดยในตอนนั้นเมนเดเลเอฟได้จัดธาตุที่มีสมบัติคล้ายคลึงกันที่ปรากฏซ้ำกันเป็นช่วง ๆ
ให้อยู่ในแนวตั้งหรือหมู่เดียวกันและพยายามเรียงลำดับมวลอะตอมของธาตุจากน้อยไปหามาก
ถ้าเรียงตามมวลอะตอมแล้วมีสมบัติไม่สอดคล้องกัน
ก็พยายามจัดให้เข้าหมู่โดยเว้นช่องว่างไว้ในตำแหน่งที่คิดว่าน่าจะเป็นธาตุที่ยังไม่มีการค้นพบ
และยังได้ใช้สมบัติของธาตุและสารประกอบอื่นๆ
นอกเหนือจากคลอไรด์และออกไซด์มาประกอบการพิจารณาด้วย
โดยตำแหน่งของธาตุในตารางจะมีความสัมพันธ์กับสมบัติของธาตุ
ซึ่งช่วยให้เมนเดเลเอฟสามารถทำนายสมบัติของธาตุในช่องว่างที่ยังไม่มีการค้นพบได้อย่างใกล้เคียง
จริงๆ แล้วธาตุยูเรเนียม (เลขอะตอม =92) เป็นธาตุที่หนักที่สุดที่พบได้ในธรรมชาติ
แต่นักวิทยาศาสตร์ก็พยายามสังเคราะห์ธาตุที่หนักมากกว่า
โดยการให้โปรตอนเพิ่มเข้าไปในนิวเคลียสของธาตุใดๆ
ผ่านปฏิกิริยาฟิวชั่น ในช่วงหลายปีที่ผ่านมา
นักวิทยาศาสตร์สามารถสร้างธาตุที่หนักมากกว่ายูเรเนียมและหนักมากขึ้นไปเรื่อยๆ
ได้สำเร็จหลายธาตุ ซึ่งนักวิทยาศาสตร์เหล่านั้นต่างอยากทราบว่าอะตอมที่ใหญ่ที่สุด
จะใหญ่ได้สักเท่าไร มีโปรตอนสูงสุดเท่าไร และตารางธาตุที่เราใช้กันอยู่จะสิ้นสุดที่ธาตุใด
แต่เดิมนักวิทยาศาสตร์คาดว่าธาตุโลหะซุปเปอร์เฮฟวี่ (Super-heavy Metal คือธาตุที่มีจำนวนโปรตอน 104 ขึ้นไป) นั้น
น่าจะมีค่าครึ่งชีวิตที่ยาวนาน จึงเป็นที่น่าสนใจและพยายามค้นหาธาตุเหล่านั้น
แต่ปรากฏว่ายิ่งมีการเพิ่มนิวตรอนและโปรตอนลงไปในนิวเคลียสลงไปมากเท่าใด
อะตอมก็ยิ่งมีความเสถียรน้อยลง ธาตุโลหะซุปเปอร์เฮฟวี่ส่วนใหญ่จึงอยู่ได้เพียงแค่เพียงไมโครหรือนาโนวินาทีเท่านั้น
อย่างไรก็ตามหลังจากมีการสร้างธาตุโลหะซุปเปอร์เฮฟวี่ได้มากขึ้นก็มีข้อสังเกต
จนกระทั่งตั้งเป็นทฤษฎีที่เกี่ยวกับความเสถียรของธาตุซุปเปอร์เฮฟวี่เหล่านี้ว่า
ถ้าเพิ่มจำนวนเลขอะตอมไปถึงค่าๆ หนึ่ง ธาตุซุปเปอร์เฮฟวี่ที่ได้
จะมีเสถียรภาพมากและอยู่ได้นานขึ้น เรียกทฤษฎีนี้ว่า Island of stability
โดยคาดการณ์กันว่าธาตุตัวที่จะมีเสถียรภาพมากพอที่จะตรวจสอบได้คือธาตุที่ 120
เพราะจะมีสมบัติแบบธาตุหมู่ 2 (แอลคาไลน์ เอิร์ท)
ซึ่งปัจจุบัน นักวิทยาศาสตร์ก็ยังคงรอคอยการพิสูจน์ทฤษฎีนี้อย่างใจจดใจจ่อกันเลยทีเดียว
ในปี 2010 นักวิทยาศาสตร์ชาวรัสเซียและอเมริกาได้ร่วมมือกันนำเสนอ
การสังเคราะห์และตรวจสอบถึงการมีอยู่ของธาตุชนิดใหม่ที่มีเลขอะตอม 117
และมีชื่อชั่วคราวว่า อุนอุนเซพเทียม http://www.vcharkarn.com/vnews/448724
ต่อมาเมื่อต้นปี 2014 นักวิทยาศาสตร์ชาวเยอรมันสามารถสังเคราะห์ธาตุชนิดใหม่นี้ได้อีกครั้ง
รวมทั้งตรวจสอบสมบัติของธาตุชนิดนี้ด้วย ธาตุนี้หนักเป็นอันดับสอง รองจากอุนอุนออกเทียม
ที่มีเลขอะตอมเท่ากับ 118 และเพิ่งค้นพบก่อนหน้าไม่นาน
โดยธาตุอุนอุนเซพเทียมได้สังเคราะห์ขึ้นจากแคลเซีม (เลขอะตอม 20)
และเบอร์เคลเลียม (เลขอะตอม 97) ขณะนี้อยู่ระหว่างการตั้งชื่ออย่างเป็นทางการ
จาก International Union of Pure and Applied Chemistry (IUPAC)
อย่างไรก็ตามการค้นพบธาตุตัวที่ 117 ซึ่งเป็นธาตุตัวใหม่ล่าสุด
ก็ทำให้ตารางธาตุถูกเติมเต็มในแถวที่ 7 โดยครบสมบูรณ์
และช่วยสนับสนุนแนวความคิด Island of stability ด้วย
จากนั้นเราก็ต้องมารอธาตุตัวต่อไปที่จะถูกค้นพบ
และมาเริ่มต้นแถวที่ 8 รวมทั้งการพิสูจน์แนวความคิด Island of stability ว่าถูกต้อง เป็นจริงหรือไม่
และต้องรอติดตามกันต่อไปว่าธาตุในตารางธาตุจะถูกค้นพบไปเรื่อยๆ หรือจะหยุดเพียงแค่ธาตุตัวใดตัวหนึ่ง
ป.ล. เป็นบทความดีดีที่เขือไปเจอมา หวังว่าจะเป็นประโยชน์ต่อใครหลายๆ คน
แวะเข้าไปดูกันได้ที่ http://www.vcharkarn.com/varticle/500208
[Spoil] คลิกเพื่อดูข้อความที่ซ่อนไว้